| Ion testé |
Cℓ- |
| Réactif |
Nitrate d'argent |
| Protocole |
Verser quelques gouttes de nitrate d'argent
dans un tube à essais contenant la solution testée. |
| Observation |
? |
| Ion testé |
Ion Fer II -
Fe2+ |
Ion Fer III
- Fe3+ |
Ion Cuivre -
Cu2+ |
| Réactif |
Soude |
||
| Protocole |
Verser quelques
gouttes de soude
dans un tube à essais contenant la solution testée. |
||
| Observation |
? |
? |
? |

 |
|
 |
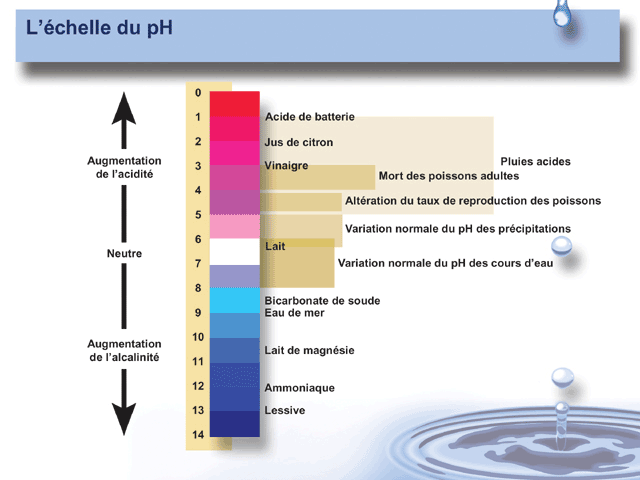
Le pH se mesure :

|


 |
Les solutions acides et basiques comportent des pictogrammes de sécurité.
|
| Soude concentrée |
pH proche de 14 |
 |
| Acide sulfurique concentré |
pH proche de 0 |
  |