En mettant en contact de la poudre de zinc et une solution de sulfate de cuivre on observe que :
Equation de réaction :
Cu2+ + Zn → Cu + Zn2+

 |
En mettant en contact de la poudre de zinc et une solution de sulfate de cuivre on observe que :Equation de réaction :
|
 |
|
 |
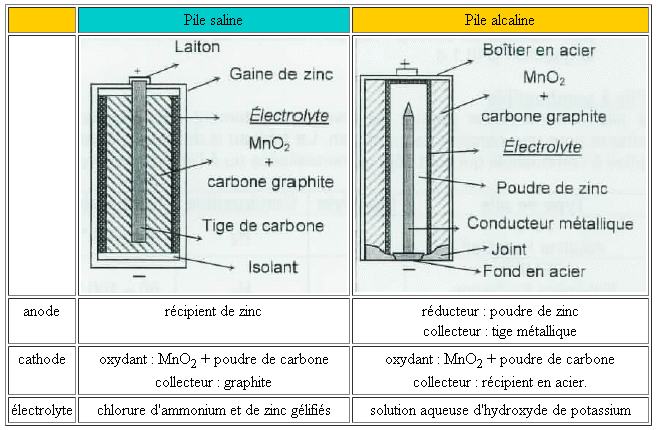
Pour réaliser une pile il faut mettre en contact :Par exemple avec une lame de cuivre, une lame de zinc et comme électrolyte une solution de sulfate de cuivre : Video : c'est pas sorcier | Questionnaire | CorrigéSchématisation d'une pile | Corrigé |